过敏性鼻炎在中国已成为日益严峻的公共卫生挑战。快速城市化进程与空气污染问题的加剧,尤其是机动车使用量的持续增长,已成为推动过敏性鼻炎发病率上升的重要因素。研究表明,环境与遗传因素均为疾病发作的关键诱因,即便空气中污染物水平仅出现轻微上升,也可能显著加重患者的症状。
基于此背景,我们推出《2025年中国过敏性疾病药物行业系列报告:过敏性鼻炎生物制剂治疗进展与医保覆盖》。该报告深度剖析行业现状与未来趋势,为您揭示行业现状、药物格局、研发趋势及核心痛点,并结合政策动态与技术创新,展望未来市场高质量发展路径。并且我们持续关注过敏性疾病药物行业发展动向,未来将持续推出系列报告,敬请关注!
报告关注的核心问题:
1. 过敏性鼻炎现有治疗药物格局如何?
2. 中国过敏性鼻炎药物市场规模如何?未来将如何发展?
3. 全球和中国用于过敏性鼻炎的生物制剂研发进程如何?未来将如何改变用药格局?
中国过敏性鼻炎药物市场规模及增长驱动力是什么?
中国对过敏性疾病的认知正从症状导向转向免疫机制驱动的精准诊疗时代。免疫学研究的突破揭示了II型炎症通路的核心作用,包括Th2细胞、ILC2及IL-4/IL-5/IL-13等细胞因子,为靶向生物制剂的开发奠定了基础。这类创新疗法通过精准调节免疫反应,在提升疗效的同时显著降低全身性副作用,逐步替代传统非特异性药物。
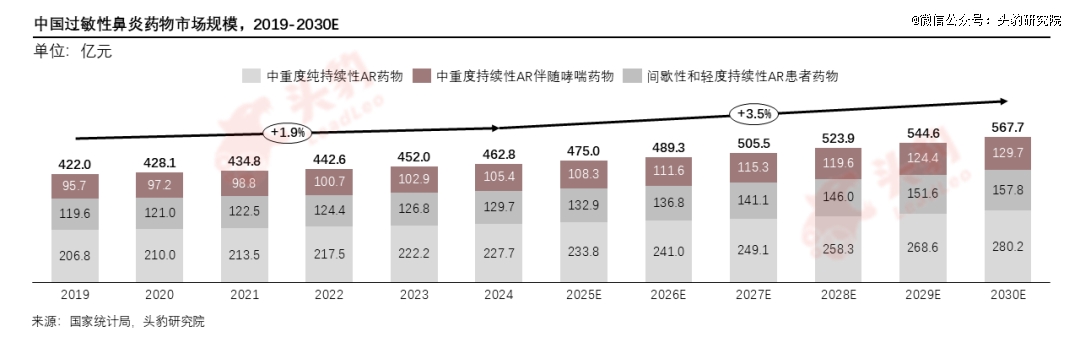
中国过敏性鼻炎药物市场规模由2019年的422.0亿元增加至2024年的462.8亿元,年复合增速为1.9%,预计未来将以3.5%的增速持续增长至2030年的567.7亿元。
过敏性鼻炎患者的用药需求因病情严重程度不同而不同,各细分规模变化各异。据推算,2024年中国间歇性及轻度持续性AR占整体AR患者的比例达52.8%,中重度纯持续性AR占整体AR患者的比例达18.5%,中重度持续性AR伴随哮喘占整体AR患者的比例达28.6%。中重度持续性AR伴随哮喘病症复杂,需要综合性的治疗策略,包括长期使用多种类型的药物以及可能的辅助疗法,用药方案成本更高,致使该部分规模在整体市场占据最 大份额。
未来,过敏性鼻炎与哮喘的高转化率凸显长期管理的重要性,患者对早期干预和持续治疗的重视直接推动用药需求增长。另一方面,免疫治疗因药品单一、疗程长、年费用近万元且未纳入医保等局限,短期内难以替代药物治疗,传统用药仍为多数患者首 选,AR用药市场规模将持续增长。
传统药物治疗过敏性鼻炎的药物有哪些?有何优缺点?
过敏性鼻炎的常用治疗药物根据临床推荐等级分为一线、二线和三线用药。一线药物是临床首 选,包括鼻用糖皮质激素、第二代口服及鼻用抗组胺药(如氯雷他定、西替利嗪),以及口服白三烯受体拮抗剂(如孟鲁司特钠)。其中,鼻用糖皮质激素通过直接抑制鼻腔炎症反应改善鼻塞、流涕等症状;第二代抗组胺药起效快且作用持久,对鼻痒、喷嚏和流涕效果显著;白三烯受体拮抗剂则更擅长缓解鼻塞。
二线药物需根据病情酌情使用,如口服糖皮质激素适用于症状严重者的短期控制,肥大细胞膜稳定剂安全性高但起效较慢,鼻用减充血剂(如羟甲唑啉)可快速缓解鼻塞但需严格限制使用时间(不超过7天),鼻用抗胆碱能药(如异丙托溴铵)则主要针对流涕症状。
三线药物为生物制剂,以奥马珠单抗为代表,目前主要用于合并严重过敏性哮喘且常规治疗无效的患者,其适应症尚未完全覆盖单纯过敏性鼻炎。
IL-4R单抗在过敏性鼻炎治疗中的适应症拓展计划及临床价值是什么?
2型炎症性疾病是以2型免疫应答的慢性失衡导致的2型炎症反应为共同特征的一大类疾病的统称,包括特应性皮炎、过敏性鼻炎、哮喘、特应性皮炎、食物过敏等多种疾病。2型免疫应答主要由2型天然淋巴细胞、2型辅助性T细胞(Th2)参与,其中Th2细胞介导的2型免疫反应中IL-4/13处于中枢位置。作为IL-4与IL-13受体的共同亚基,IL-4Rα可抑制IL-4和IL-13双信号通路,阻断2型炎症发展,是2型炎症性疾病的有效靶点,近年针对IL-4Rα靶点的药物研发热度不断升温。
2025年2月7日,康诺亚宣布,公司自主研发的1类新药康悦达获国家药品监督管理局批准上市,用于治疗季节性过敏性鼻炎(SAR)。这是康悦达继2024年9月、12月批准用于治疗成人中重度特应性皮炎、慢性鼻窦炎伴鼻息肉之后获批的第三个适应症,成为目前全球获批治疗季节性过敏性鼻炎的IL-4Rα生物制剂,给患者提供突破性治疗选择。其临床研究结果显示,司普奇拜单抗能够快速强效控制患者的鼻部症状,持续显著缓解患者眼部过敏症状,极大提升患者生活质量,且安全性良好。全球还有四种用于季节性过敏性鼻炎的抗IL-4R单抗正在临床开发中,MG-K10为全球进度最领 先的抗IL-4R单抗之一。国内多款同类药物处于临床后期,未来越来越多的IL-4Rα药物获批上市和适应症扩展,将为过敏性鼻炎等2型炎症性疾病患者带来新的治疗选择。
抗IgE抗体在过敏性鼻炎治疗中的技术瓶颈及突破路径是什么?
全球首 个抗IgE抗体奥马珠单抗于2003年首次获FDA批准,目前获得NMPA批准的适应证是成人和6岁以上儿童中-重度持续性变应性哮喘,尚未批准用于单纯AR。由IgE介导的变应性哮喘合并严重AR患者,在过敏原回避和基础药物治疗效果不佳时,临床推荐使用奥马珠单抗治疗。
传统疗法的副作用和有限疗效导致临床实践向靶向生物制剂疗法转变。抗IgE抗体等创新药因其卓 越的安全性和疗效,已逐渐成为中重度过敏患者的标准治疗方案。目前尚未有抗IgE抗体药物获批用于单纯AR治疗, 2024年,奥马珠单抗获FDA批准用于预防食物过敏。随着适应症的持续扩展,抗IgE抗体适用的患者群体也持续增加。
现有的抗IgE抗体药物通过扩大适应症和优化给药方案保持了市场活力。新一代抗IgE药物的研发正在加速,包括剂型创新和针对不同过敏原表型的精确设计。生物仿制药的上市进一步丰富了市场选择,形成了原研药、改良新药和生物仿制药并存的产品多元化格局,共同推动抗IgE抗体市场的发展。
免责声明:该文章系本站转载,旨在为读者提供更多信息资讯。所涉内容不构成投资、消费建议,仅供读者参考。